Ejemplo de balanceo por tanteo de neutralización del sulfato de sodio con el ácido clorhídrico:
1. Tomamos en consideración los radicales de las sustancias que reaccionan, así como las que se producen. Veamos las siguiente reacción de neutralización del sulfato de sodio con el ácido clorhídrico:
Na2SO3 + HCl -- > NaCl + H2O + SO2
Como podemos ver, tenemos del lado izquierdo de la ecuación las sustancias reaccionantes: sulfato de sodio (Na2SO3) y ácido clorhídrico (HCl). Del lado derecho, tenemos los productos de la reacción: Cloruro de sodio o sal común (NaCl), Agua (H2O) y óxido de azúfre (SO2).
Podemos ver en esta ecuación las sustancias que reaccionan y las que se producen, con sus respectivas fórmulas. Sin embargo, para saber si esta ecuación está balanceada, debemos contar el número de átomos de uno y otro lado; si el total es el mismo de ambos lados entonces consideramos que la ecuación está balanceada. Así tenemos:
2 + 1 + 3 + 1+ 1 -- > 1 + 1 + 2 + 1 + 1 + 2
Na2SO3 + HCl -- > NaCl + H2O + SO2
Como podemos ver, el número de átomos en el primer miembro de la ecuación es menor que el segundo, por lo que la ecuación está desbalanceada.
2. Comenzaremos por identificar el número de átomos de cada elemento en ambos lados de la ecuación:
Lado izquierdo: Na = 2; S = 1; O = 3; H = 1; Cl = 1
Lado derecho : Na = 1; S = 1; O = 3; H = 2; Cl = 1
Así tenemos que del lado derecho de nuestra ecuación nos falta un átomo de sodio, mientras que sobra un átomo de hidrógeno.
3. Para balancear una ecuación al tanteo, tenemos que seguir las siguientes reglas:
a. No agregaremos elementos que no pertenezcan a la ecuación.
b. No modificaremos los radicales de los elementos de la ecuación, es decir, si de un lado el hidrógeno tiene un radical 2, debe seguir con el radical 2.
c. Sí podemos expresar al aumento de átomos agregando el número de átomos de alguno de los compuestos de la mezcla. Así, si queremos expresar que hay 4 átomos de ácido clorhídrico, escribiremos 4HCl.
d. Es conveniente comenzar el balanceo por los elementos que sólo aparecen una vez en cada miembro, dejando al último los que aparecen más de una vez, si es necesario.
e. El hidrógeno y el oxígeno son de los últimos elementos a considerar para el balanceo.
4. No tenemos un lugar definido para comenzar nuestro balanceo, así que podemos comenzar por cualquiera de los miembros de la ecuación. Comenzaremos con los átomos de sodio. Como vemos, en el primer miembro hay dos átomos de sodio para reaccionar en la molécula de sulfato de sodio, mientras que del lado derecho, en la sustancia producida, el cloruro de sodio, sólo hay un átomo de sodio. Esto significa que para equilibrar el sodio y que haya dos átomos en el resultado, debe haber dos moléculas de cloruro de sodio en el lado derecho de la reacción. Así tendríamos:
2 + 1 + 3 + 1+ 1 -- > 2 +2 + 2 + 1 + 1 + 2
Na2SO3 + HCl -- > 2NaCl + H2O + SO2
5. Como vemos, ya tenemos la misma cantidad de átomos de sodio. Pero nuestra ecuación sigue desequilibrada. En efecto, ahora tenemos:
Lado izquierdo: Na = 2; S = 1; O = 3; H = 1; Cl = 1
Lado derecho : Na = 2; S = 1; O = 3; H = 2; Cl = 2
6. Ahora tenemos dos átomos de cloro en el resultado y sólo uno en los reactivos. Si consideramos que el resultado de la reacción produce dos átomos de sal, y sólo hay un átomo de cloro en la molécula que reacciona, significa que ahora debemos considerar que actúan dos moléculas del compuesto que contiene el cloro, o sea, dos moléculas de ácido clorhídrico. Para comprobar si nuestra suposición es cierta, agregamos a nuestra fórmula la indicación de que están reaccionando dos átomos de HCl y volvemos a contar los átomos:
2 + 1 + 3 + 2 + 2 -- > 2 +2 + 2 + 1 + 1 + 2
Na2SO3 + 2HCl -- > 2NaCl + H2O + SO2
7. Ahora ya tenemos el mismo número de átomos reaccionando de uno y otro lado de la ecucación. Finalmente revisamos que en ambos lados exista el mismo número de átomos de cada elemento:
Lado izquierdo: Na = 2; S = 1; O = 3; H = 2; Cl = 2
Lado derecho : Na = 2; S = 1; O = 3; H = 2; Cl = 2
Tenemos el mismo número de átomos de cada elemento en ambos lados de la ecuación, lo que significa que nuestra fórmula está correctamente balanceada. También podemos apreciar que al comenzar a balancear por los elementos que sólo aparecen una vez, otros átomos, en este caso el hidrógeno, cambia sus valores dependiendo de la molécula en la que se encuentra combinado y la cantidad de moléculas que actúan en la ecuación, equilibrándose también junto con el resto de elementos.
Ejemplo de balanceo por tanteo del ácido nítrico con el hidróxido de calcio:
Ahora vamos a balancear la ecuación de la reacción del ácido nitrico con el hidróxido de calcio, la cual produce nitrato de calcio y agua:
HNO3 + Ca(OH)2 -- > Ca(NO3)2 + H2O
1. Comenzamos contando los átomos en cada lado de le ecuación y los átomos de cada elemento de la ecuación:
1 + 1 + 3 + 1 + 2 + 2 -- > 1 + 2 + 6 + 2 + 1
HNO3 + Ca(OH)2 -- > Ca(NO3)2 + H2O
Lado izquierdo: N = 1; Ca = 1; O = 5; H = 3
Lado derecho : N = 2; Ca = 1; O = 7; H = 2
Comenzaremos pues nuestro balance con el nitrógeno. Del lado de las reacciones tenemos dos átomos, mientras que en los reactivos, sólo hay uno. Esto podemos equilibrarlo considerando que actúan dos moléculas de ácido nítrico, por lo que nuestra fórmula y nuestro conteo de átomos quedarían así:
2 + 2 + 6 + 1 + 2 + 2 -- > 1 + 2 + 6 + 2 + 1
2HNO3 + Ca(OH)2 -- > Ca(NO3)2 + H2O
Lado izquierdo: N = 2; Ca = 1; O = 8; H = 4
Lado derecho : N = 2; Ca = 1; O = 7; H = 2
Ya equilibramos el nitrógeno, pero la ecuación aún está desbalanceada.
2. Observando nuestra ecuación, vemos que ya tenemos el mismo número de átomos de nitrógeno y de calcio. Esto significa que ya tenemos la cantidad adecuada de moléculas de ácido nítrico y de hidróxido de calcio para producir una molécula de nitrato de calcio. Comparando los átomos de todos los elementos, tenemos que a la ecuación de lado derecho le falta una molécula de oxígeno y dos de hidrógeno para estar equilibrada ¿Esto qué significa? Bien, pues una molécula de oxígeno y dos de hidrógeno producen agua, y como ya hay una molécula de agua presente en la reacción, significa que no es una sino dos las moléculas de agua que se producen.
Agregamos a nuestra fórmula que se producen dos moléculas de agua, y volvemos a contar átomos y elementos:
2 + 2 + 6 + 1 + 2 + 2 -- > 1 + 2 + 6 + 4 + 2
2HNO3 + Ca(OH)2 -- > Ca(NO3)2 + 2H2O
Lado izquierdo: N = 2; Ca = 1; O = 8; H = 4
Lado derecho : N = 2; Ca = 1; O = 8; H = 4
BALANCEO POR OXIDO REDUCCIÓN
Caso 1
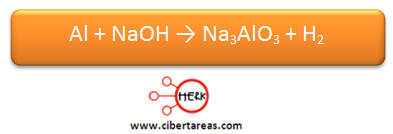
Se necesita realizar el balanceo de la siguiente ecuación:
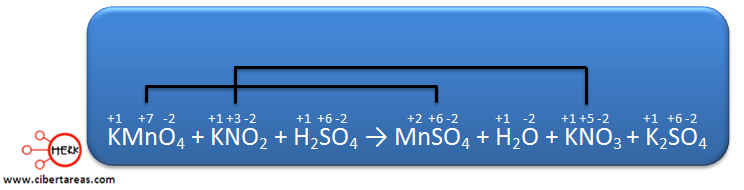
1.- Es necesario determinar los números de oxidación de todos los elementos, estos números son:
Analizando la ecuación podemos decir que los dos elementos cambian su estado de oxidación:
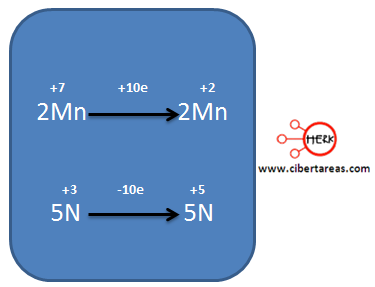
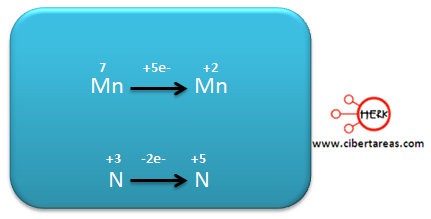
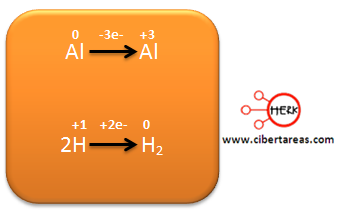
– El Mn pasa de +7 en los reactivos a +2 en los productos
– El N, pasa de +3 en los reactivos a +5 en los productos
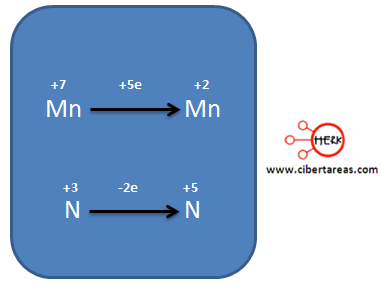
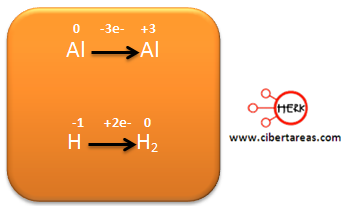
Al observar el siguiente esquema podemos analizar dos semirreacciones, una para el Mn y otra para el N, indicando los electrones que se ganan o pierden.
Al analizar el diagrama, tenemos que:
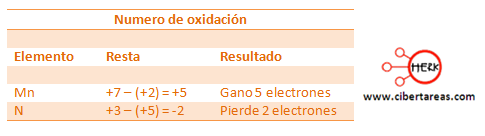
– El Mn pasa de +7 a +2, gano 5 electrones, es decir se reduce
– El N para de +3 a +5, perdió 2 electrones, es decir se oxida.
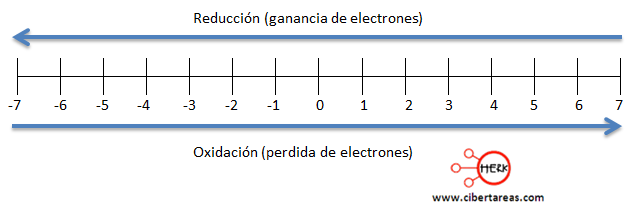
Existe otra forma para saber cuántos electrones se ganan o pierden, esta es:
– Se resta el número de oxidación que se presenta en los reactivos con el número de oxidación que sé que presenta en el producto.
– Si el resultado es negativo, el elemento perdió electrones
– Si el resultado es positivo, el elemento gano electrones
Siguiendo el ejemplo y aplicando este método tenemos que:
2.- El siguiente paso es escribir des medias reacciones:
-La primera par el átomo que gana electrones (reducción)
-La segunda para el átomo que pierde electrones (Oxidación)
3.- El paso siguiente es balancear los átomos en cada una de las semirreacciones, es importante considerar que cualquier cambio en los coeficientes se refleja en los electrones que se han ganado o perdido.
Para este ejemplo, ya están balanceados
4.- El siguiente paso es balancear los electrones ganados y perdidos, para lograr esto:
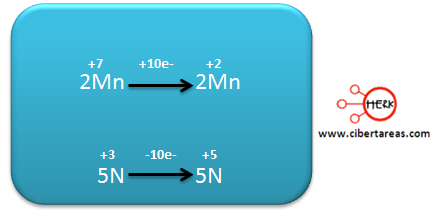
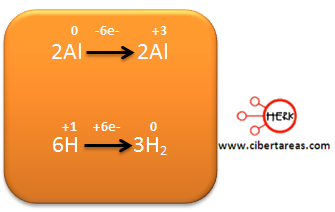
-Se multiplica en forma cruzada las dos semirreacciones
-Para nuestro caso se multiplica la primera por 2 y la segunda por 5
5.- A los productos de la reacción se les asignan los coeficientes encontrados, y posteriormente se ajustan sucesivamente la ecuación hasta que se finalice el balanceo
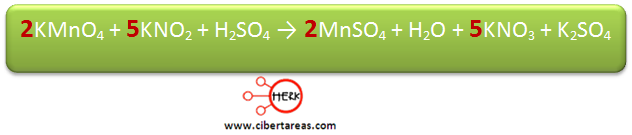
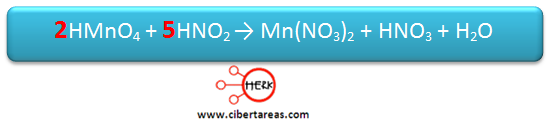
Se iguala el número de átomos de Mn, esto se hace colocando el coeficiente 2 en el KMnO4
Posteriormente se iguala el número de átomos de N, esto lo realizamos colocando el coeficiente 5 en KNO2
Observemos que los átomos de potasio se encuentran balanceados debido a:
-Existen 7 átomos en los reactivos y 7 en los productos.
Sin embargo los átomos del azufre no se encuentra balanceados ya que:
-Existen 1 átomo en los reactivos y 3 en los productos
Por esta razón se coloca un coeficiente 3 en H2SO4
Una vez que se coloca este coeficiente en el ácido sulfúrico, se tiene:
-Existen 6 átomos de hidrogeno en los reactivos y 2 en los productos.
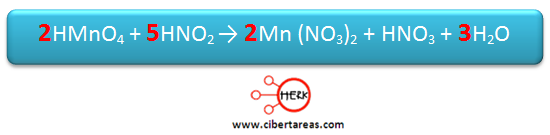
Al asignar un coeficiente 3 al H2O se ha terminado de balancear la ecuación
Antes de terminar, es necesario verificar si se ha balaceado correctamente, esto se hace contando los átomos de oxígeno en reactivos y determinar si son iguales en los productos:
Caso 2
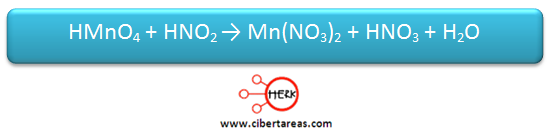
Es necesario realizar el balanceo por el método de óxido-reducción a la siguiente reacción:
1.- Se obtienen los números de oxidación para la reacción:
2.- Se determina cuáles son los elementos que cambian su número de oxidación cuando pasan de ser reactivos a productos:
3.- Se procede a balancear los átomos en cada semirreaccion, dado nuestro ejemplo no es necesario, ya que solo hay un átomo a cada lado en las dos semirreacciones.
4.- En este paso, se balancean los electrones perdidos con los ganados, para esto:
-Se realizan las multiplicaciones, la primera semirreaccion se multiplica por 2 y la segunda por 5
5.- Se le asigna a los productos de la reacción los coeficientes encontrados, mediante el tanteo, con esto se finaliza el balanceo:
5.1 Se le asignan los coeficientes
5.2 Por orden: metales, no metales, hidrógenos y oxígenos
5.3 Se verifica el correcto balanceo contando los átomos de oxigeno presentes en los reactivos para verificar que coincidan con los del producto
Caso 3
Es necesario balancear la siguiente ecuación por el método de óxido-reducción
1.- Se obtienen los números de oxidación
2.- Se determinan los elementos que cambian su número de oxidación al pasar de reactivos a productos
3.- Se balancean los átomos en cada semirreacción, esto dependiendo del caso, para nuestro ejemplo es necesario hacerlo
4.- Se balancean los electrones que se han perdido con los ganados, para realizar esto, se realiza una multiplicación:
– La primera semirreacción por 2 y la segunda semirreacción por 6
5.- Para finalizar el balanceo, se asignan estos coeficientes mediante el tanteo
BALANCEO POR MÉTODO ALGEBRAICO
Este método nos indica:
Ejemplo:
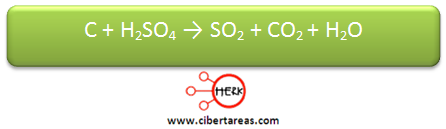
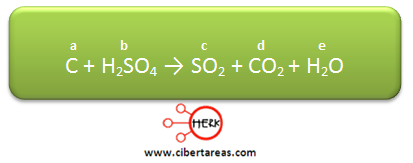
Se necesita realizar el balanceo a la siguiente ecuación química:
1.- Se le asigna una letra a cada especie química:
2.- Se cuentan los átomos de cada elemento químico, y con estos e establece una ecuación para cada uno de ellos:
2.1 En el caso del carbono:
a = d
Ya que existe un átomo en la especie marcada con la letra a y d
La fleca de la reacción se ha cambiado por el signo =
2.2 Para el caso del oxígeno:
4b = 2c + 2d + e
Ya que existen:
4 átomos de oxígeno en b
2 átomos de oxígeno en c
2 átomos de oxígeno en d
1 átomo de oxígeno en e
El signo de suma “+” se respeta de la reacción original, y este aparece en la ecuación correspondiente
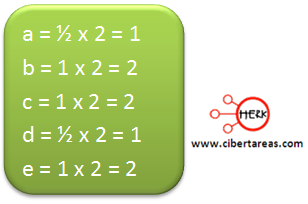
3.- Tenemos que hacer énfasis que la letra que aparece en mas ecuaciones se le asigna el valor de 1, en este caso es la letra b.
Al observar estos resultados, podemos decir que:
La ecuación numero 3 ya está resuelta, nos da un valor de 1 para la letra c
La ecuación número 2 se resuelve despejando y nos da un valor de 1 para la letra e
Al tener estos valores (de la letra b y e) se pueden resolver las ecuaciones número 1 y 4, entonces tenemos que:
Tenemos que la ecuación número 1 nos indica que a = d, por consecuencia a = ½
En resumen tenemos que:
A pesar que ya se tienen los coeficientes, todavía no se puede balancear la ecuación química, ya que a y d tienen un valor en fracciones, la solución para tener números enteros es multiplicar los cinco coeficientes por 2
4.- Se le asignan los coeficientes y es necesario verificar que la ecuación cumpla con la ley de la conservación de la masa, es decir, si existe igual número de átomos de cada especia en los reactivos como en los productos
Ahora realicemos la comprobación:
La ecuación se ha balanceado y cumple con la ley de la conservación de la masa
BALANCEO POR MÉTODO POR ION ELECTRÓN
- rocedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras Para ilustrar paso a paso el procedimiento a seguir, analizaremos una ecuación esquemática que incluya aquellos reactivos y productos que hayan experimentado cambios en su estado de oxidación. H₂SO₃ + MnO -------- SO 2- + Mn2+ ( en medio ácido). 4 Paso 1: asignar correctamente el número de oxidación a todos los átomos que participan en la reacción. Paso 1: H2+ S4+ O3= + Mn7+ O4-------S6+O42- + Mn2+ 4 Paso 2: Observar e identificar cuáles fueron los elementos que experimentaron cambios en los estados de oxidación y con ellos plantear semirreacciones para el agente oxidante y el agente reductor Paso 2: 1) H2+S4+O3= ------- S6+O42- Agente reductor. 2) Mn7+ O4- ------- Mn2+ Agente oxidante
- 4. Procedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras Paso 2: 1) H2+S4+O3= ------- S6+O42- Agente reductor. 2) Mn7+ O4- ------- Mn2+ Agente oxidante El agente reductor es el H₂SO₃ porque contiene el S, que se oxida al aumentar su estado de oxidación de 4+ a 6+ El agente oxidante es el ion MnO4- porque contiene el Mn, que se reduce al cambiar su estado de oxidación de 7+ a 2+
- 5. Procedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras. Paso 3: Igualar cada semireacción en cuanto al número de átomos de cada elemento . Si se trata de soluciones ácidas o neutras, se añade H2O y H+ para balancear el oxígeno y el hidrógeno. Por cada átomo de oxígeno que se encuentra en exceso, en un lado de la ecuación, se agrega una molécula de agua (H2O ) en el otro lado de la ecuación. De la misma forma, se añaden iones H+ para igualar los átomos de hidrógeno. Paso 3: Para balancear el oxígeno, se adicionan moléculas de H2O 1) H2+S4+O3= + H2O ------2) Mn7+ O4- ------- Mn2+ S6+O42+ 4H2O Para balancear el hidrógeno, se añaden iones 1) H2+S4+O3= + H2O ------2) Mn7+ O4- + 8H+ ------- S6+O42- + 4H+ Mn2+ + 4H2O H+ :
- 6. Procedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras. Paso 4: Igualar cada semireacción en cuanto al número de cargas añadiendo electrones en el primer o segundo miembro de la ecuación. Paso 4: Para balancear las cargas agregamos electrones donde sea necesario. La carga en el segundo miembro de la ecuación (1) es 2+; por tanto debemos añadir dos electrones (2e-)en el lado izquierdo. Ecuación(1) H2+S4+O3= + H2O ------- S6+O42- + 4H+ + 2e- (se oxidó) La carga en la ecuación (2) es 5+ por tanto, debemos agregar electrones (5e-) en el lado derecho Ecuación (2)Mn7+ O4- + 8H+ + 5e- ------- Mn2+ cinco + 4H2O (se redujo)
- 7. Procedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras. Paso 5: Igualar la pérdida y ganancia de electrones en ambos lados, multiplicando cada semireacción por los mínimos coeficientes. Paso 5: Se procede ahora igualar el número de electrones, multiplicando por el entero más pequeño. De esta manera, multiplicamos la ecuación (1) por 5 y la ecuación (2) por 2. Ecuación(1) 5(H2+S4+O3= + H2O ------- S6+O42- + 4H+ + 2e- ) Ecuación (2) 2(Mn7+ O4- + 8H+ + 5e- ------- Mn2+ + 4H2O)
- 8. Procedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras. Paso 6: sumar las dos semirreacciones y simplificar todos los términos comunes en ambos lados de la ecuación resultante. Paso 6: Finalmente sumamos las dos semirreacciones para obtener una reacción balanceada: 5H2+S4+O3= + 5H2O ------2Mn7+ O4- + 16H+ + 10e- ------- 5S6+O42- + 20H+ + 10e2Mn2+ + 8H2O 5H2+S4+O3= + 5H2O + 2Mn7+ O4- + 16H+ + 10e- ------5S6+O42- + 20H+ + 10e- + 2Mn2+ + 8H2O
- 9. Procedimiento para balancear ecuaciones por el método del Ion – Electrón en soluciones ácidas o neutras. Paso 7: reducir términos semejantes , y simplificar los coeficiente, en caso de ser posible, para obtener la ecuación final. Paso 7: Y Reducimos términos semejantes, para obtener la ecuación final así: 5H2+S4+O3= + 5H2O + 2Mn7+ O4- + 16H+ + 10e- ------5S6+O42- + 20H+ + 10e- + 2Mn2+ + 8H2O Para obtener la ecuación final así: 5H2SO3= + 2MnO4-------- 5SO42- + 2Mn2+ + 3H2O + 4H+
- 10. Aun cuando en las reacciones químicas se pueden producir efectos sorprendentes, la ley de la conservación de la materia siempre se cumple. El método del Ion – Electrón es utilizado particularmente para hallar los coeficientes en una ecuación Redox






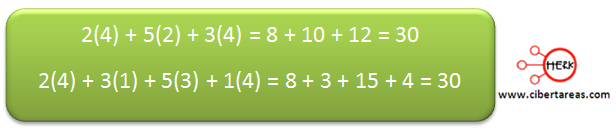

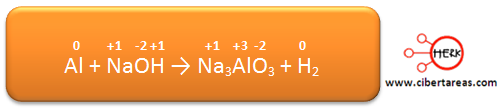






No hay comentarios:
Publicar un comentario